Lớp 11 - Hóa học - Nâng cao Giải bài 1, 2, 3, 4, 5 trang 57 SGK Hóa học 11 Nâng cao
Câu 1 trang 57 SGK Hóa học 11 Nâng cao
Viết các phương trình hóa học để thực hiện các sơ đồ chuyển hóa sau:
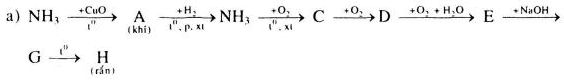
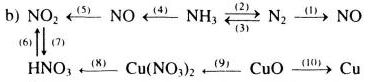
Giải
a)
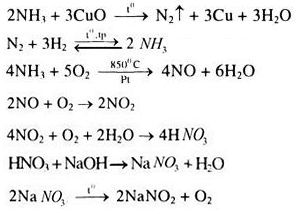
b)

Câu 2 trang 58 SGK Hóa học 11 Nâng cao
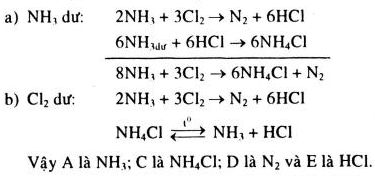
Chất khí A có mùi khai, phản ứng với khí clo theo cách khác nhau sau đây, tùy theo điều kiện phản ứng.
a) Trong trường hợp dư khí A thì xảy ra phản ứng sinh ra chất rắn C và khí D:
\(8A + 3C{l_2} \to 6C + D\)
b) Trong trường hợp dư khí clo thì phản ứng sinh ra khí D và khí E:
\(2A + 3C{l_2} \to D + 6E\)
Chất rắn C màu trắng, khi đốt nóng thường bị phân hủy thuận nghịch, biến thành chất A và chất E. Khối lượng riêng của khí D là 1,25 g/l (đktc).
Giải
Ta có \({M_D} = 1,25.22,4 = 28g/mol \Rightarrow \) khí D là \({N_2}\) ; khí A là \(N{H_3}\)
Câu 3 trang 58 SGK Hóa học 11 Nâng cao
Hãy chọn đáp án đúng trong các trường hợp sau:
a) Phản ứng giữa kim loại magie với axit nitric đặc giả thiết chỉ tạo ra đinittơ oxit. Tổng các hệ số trong phương trình hóa học bằng:
A. 10. B. 18.
C. 24. D. 20
b) Phản ứng giữa kim loại Cu với axit magie loãng giả thiết chỉ tạo ra nittơ monoxit. Tổng các hệ số trong phương trình hóa học bằng:
A. 10. B. 18.
C. 24. D. 20
Giải
a) \(4Mg + 10HN{O_3}\) (đặc) \( \to 4Mg{(N{O_3})_2} + {N_2}O \uparrow + 5{H_2}O\)
Chọn đáp án C
b) \(3Cu + 8HN{O_{3(l)}} \to 3Cu{(N{O_3})_2} + 2NO \uparrow + 4{H_2}O\)
Chọn đáp án D
Câu 4 trang 58 SGK Hóa học 11 Nâng cao
Trình bày phương pháp hóa học để phân biệt các dung dịch sau: \(N{H_3},{(N{H_4})_2}S{O_4},N{H_4}Cl,N{a_2}S{O_4}.\)Viết phương trình hóa học.
Giải
Nhận biết các dung dịch \(N{H_3},{(N{H_4})_2}S{O_4},N{H_4}Cl,N{a_2}S{O_4}.\)
- Dùng đũa thủy tinh nhúng vào dung dịch HCl đặc và đưa vào các mẫu thử trên, mẫu thử có khỏi trắng xuất hiện là dung dịch \(N{H_3}\)
\(N{H_3} + HCl \to N{H_4}Cl\)
- Dùng dung dịch \(Ba{(OH)_2}\) cho vào 3 mẫu thử còn lại
Mẫu sủi bọt có mùi khí khai, đồng thời tạo kết tủa trắng là dung dịch \({(N{H_4})_2}S{O_4}\)
\({(N{H_4})_2}S{O_4} + Ba{(OH)_2} \to BaS{O_4} \downarrow + 2NaOH\)
Mẫu sủi bọt khí mùi khai là dung dịch \(N{H_4}Cl\)
\(2N{H_4}Cl + Ba{(OH)_2} \to BaC{l_2} + 2N{H_3} \uparrow + 2{H_2}O\)
Mẫu tạo kết tủa trắng là dung dịch \(N{a_2}S{O_4}\)
\(N{a_2}S{O_4} + Ba{(OH)_2} \to BaS{O_4} \downarrow + 2NaOH\)
Câu 5 trang 58 SGK Hóa học 11 Nâng cao
Trong quá trình tổng hợp amoniac, áp suất trong bình phản ứng giảm đi 10,0% so với áp suất lúc đầu. Biết nhiệt độ của bình phản ứng được giữ không đổi trước và sau phản ứng. Hãy xác định thành phần phần trăm thể tích của hỗn hợp khí thu được sau phản ứng, nếu trong hỗn hợp đầu lượng nitơ và hiđro được lấy theo hệ số tỉ lượng.
Giải
Xét hỗn hợp ban đầu gồm 1 mol \({N_2}\) và 3 mol \({H_2}\). Đặt số mol \({N_2}\) tham gia phản ứng là x mol
\({N_2} + 3{H_2} \to 2N{H_3}\)
Trước phản ứng: 1 3 0
Phản ứng: x 3x 2x
Sau pahnr ứng: (1-x) (3-3x) 2x
Áp suất của hệ lúc đầu là \({P_1} = 10P\) , theo đề bài áp suất giảm 10% \( \Rightarrow \) áp suất của hệ lúc sau là \({P_2} = 9P\).
Trước phản ứng ta có \({P_1}{V_1} = {n_1}R{T_1}\) (1)
Sau phản ứng ta có \({P_2}{V_2} = {n_2}R{T_2}\) (2)
Bình kín và nhiệt độ không đổi, lấy (1) chia (2) ta được
\(\frac{{{P_1}}}{{{P_2}}} = \frac{{{n_1}}}{{{n_2}}} \Rightarrow \frac{{10P}}{{9P}} = \frac{{1 + 3}}{{(1 - x) + (3 - 3x) + 2x}} \Rightarrow x = 0,2\)
Hỗn hợp khí thu được sau phản ứng: \(N{H_3}\) 0,4 mol; \({N_2}\) dư 0,8 mol; \({H_2}\) dư 2,4 mol.
Thành phần phần trăm thể tích của mỗi khí trong hỗn hợp sau phản ứng.
\(\% {V_{N{H_3}}} = \% {n_{N{H_3}}} = \frac{{0,4}}{{(0,4 + 0,8 + 2,4)}}.100\% = 11,11\% \)
\(\% {V_{{N_2}}} = \% {n_{{N_2}}} = \frac{{0,8}}{{(0,4 + 0,8 + 2,4)}}.100\% = 22,22\% \)
\(\% {V_{{H_2}}} = \% {n_{{H_2}}} = \frac{{2,4}}{{(0,4 + 0,8 + 2,4)}}.100\% = 66,67\% \)
congdong.edu.vn