Lớp 11 - SBT Hóa Giải bài 9.9, 9.10, 9.11, 9.12 trang 65, 66 Sách bài tập hóa học 11
Bài tập 9.9 trang 65 sách bài tập(SBT) hóa học 11
9.9. Viết các phương trình hoá học của quá trình điều chế anđehit axetic xuất phát từ mỗi hiđrocacbon sau đây :
1. Axetilen ;
2. Etilen ;
3. Etan ;
4. Metan.
Hướng dẫn trả lời:
1.  + \({H_2}O\)
+ \({H_2}O\) 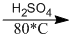
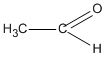
2. \(2C{H_2} = C{H_2} + {O_2}\) 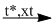 \(2C{H_3} - CHO\)
\(2C{H_3} - CHO\)
3. \(C{H_3} - C{H_3}\) 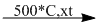 \(C{H_2} = C{H_2} + {H_2}\)
\(C{H_2} = C{H_2} + {H_2}\)
Sau đó có phản ứng 2.
4. \(2C{H_4}\) 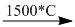
 + \(3{H_2}\)
+ \(3{H_2}\)
Sau đó có phản ứng 1.
Bài tập 9.10 trang 65 sách bài tập(SBT) hóa học 11
9.10. Chất A là một anđehit đơn chức. Cho 10,50 g A tham gia hết vào phản ứng tráng bạc. Lượng bạc tạo thành được hoà tan hết vào axit nitric loãng làm thoát ra 3,85 lít khí NO (đo ở 27,3°C và 0,8 atm).
Xác định công thức phân tử, công thức cấu tạo và tên chất A.
Hướng dẫn trả lời:
Đổi thể tích khí NO về đktc :
\({V_o} = \frac{{pV}}{T}.\frac{{{T_o}}}{{{p_o}}} = \frac{{0,8.3,85}}{{300,3}}.\frac{{273}}{1} = 2,8(l)\)
R - CHO + 2AgN03 + 3NH3 + H20 \( \to \) RCOONH4 + 2NH4N03 + 2Ag
3Ag + 4HN03 \( \to \) 3AgN03 + NO + 2H20
Số mol Ag = 3.số mol NO = 3.\(\frac{{2,8}}{{22,4}}\) = \({{{3,75.10}^{ - 1}}}\) (mol).
Số mol RCHO = \(\frac{1}{2}\)Số mol Ag = \(\frac{{{{3,75.10}^{ - 1}}}}{2}\) .
Khối lượng của 1 mol RCHO = \(\frac{{10,5.2}}{{{{3,75.10}^{ - 1}}}}\) = 56 (g).
RCHO = 56 \( \Rightarrow \) R = 56 - 29 = 27 \( \Rightarrow \) R là -C2H3
CTPT là \({C_3}{H_4}O\).
CTCT là CH2 = CH - CHO (propenal).
Bài tập 9.11 trang 65 sách bài tập(SBT) hóa học 11
9.11. Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít \({O_2}\).Sản phẩm thu được chỉ gồm có 1,80 g H20 và 2,24 lít C02. Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
Hướng dẫn trả lời:
1. Theo định luật bảo toàn khối lượng :
\({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} = \frac{{2,24}}{{22,4}}.44 + 1,8 - \frac{{3,08}}{{22,4}}.32\) = 1,8 (g)
Khối lượng C trong 1,8 g A là : \(\frac{{12.2,24}}{{22,4}}\) = 1,2 (g).
Khối lượng H trong 1,8 g A là : \(\frac{{2.1,8}}{{18}}\) = 0,2 (g).
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng CxHyOz :
x : y : z = \(\frac{{1,2}}{{12}}:\frac{{0,2}}{1}:\frac{{0,4}}{{16}}\) = 0,1 : 0,2 : 0,025 = 4:8:1
CTĐGN là C4H8O
2. MA = 2,25.32 = 72 (g/mol)
\( \Rightarrow \) CTPT trùng với CTĐGN : C4H8O.
3. Các hợp chất cacbonyl C4H8O :
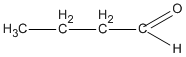 (butanal )
(butanal )
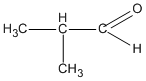 ( 2-metylpropanal )
( 2-metylpropanal )
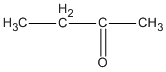 ( butan-2-ol )
( butan-2-ol )
Bài tập 9.12 trang 66 sách bài tập(SBT) hóa học 11
9.12. Hỗn hợp M chứa ba chất hữu cơ A, B và C là 3 đồng phân của nhau. A là anđehit đơn chức, B là xeton và C là ancol. Đốt cháy hoàn toàn 1,45 g hỗn hợp M, thu được 1,68 lít khí C02 (đktc) và 1,35 g \({H_2}O\).
Hãy xác định công thức phân tử, công thức cấu tạo và tên của A, B và C.
Hướng dẫn trả lời:
Ba chất A, B, C là đồng phân nên có CTPT giống nhau. A là anđehit đơn chức nên phân tử A chỉ có 1 nguyên tử oxi. Vậy A, B và C có công thức phân tử CxHyO. Khi đốt cháy hoàn toàn hỗn hợp M :
\({C_x}{H_y}O + (x + \frac{y}{4} - \frac{1}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
Theo phương trình : (12x + y + 16) g M tạo ra x mol C02 và \(\frac{y}{2}\) mol \({H_2}O\)
Theo đầu bài : 1,45 g M tạo ra \(\frac{1,68}{22,4}\) mol C02 và \(\frac{1,35}{18}\) mol \({H_2}O\)
\(\frac{{12{\rm{x}} + y + 16}}{{1,45}} = \frac{x}{{0,075}} = \frac{y}{{0,15}}\)
\( \Rightarrow \) x = 3 ; y = 6.
CTPT của A, B và C là C3H60.
A là 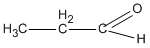 (propanal) ;
(propanal) ;
B là 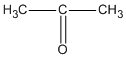 (propanon hay axeton) ;
(propanon hay axeton) ;
C là CH2 = CH - CH2 - OH (propenol).
congdong.edu.vn