Lớp 11 - SBT Hóa Giải bài 3.6, 3.7, 3.8, 3.9, 3.10 trang 22, 23 Sách bài tập hóa học 11
Bài tập trắc nghiệm 3.6 trang 22 sách bài tập(SBT) hóa học 11
3.6. Cần thêm ít nhất bao nhiêu ml dung dịch Na2CO3 0,15M vào 25 ml dung dịch Al2(SO4)3 0,02M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3 ? Biết rằng phản ứng cho thoát ra khí CO2.
Hướng dẫn trả lời:
3.6. B
3Na2CO3 + Al2(SO4)3 + 3H2O \( \to \) 2Al(OH)3\( \downarrow \) + 3CO2 + 3Na2CO4
3 mol 1 mol
x mol 0,025.0,02 mol
\( \Rightarrow \) x = 0,0015 mol
\({V_{N{a_2}C{O_3}}} = \frac{{0,0015}}{{0,15}} = 0,01(l) = 10ml\)
Bài tập 3.7 trang 22 sách bài tập(SBT) hóa học 11
3.7. Hoàn thành các phương trình hoá học sau đây (ghi rõ số oxi hoá của cacbon :
(1) \(CO + {O_2}\) ?
?
(2) \(CO + C{l_2}\)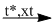 ?
?
(3) \(CO + CuO\).jpg) ? + ?
? + ?
(4) \(CO + F{{\rm{e}}_3}{O_4}\) ? + ?
? + ?
(5) \(CO + {I_2}{O_5}\) \({I_2}\) + ?
\({I_2}\) + ?
Trong các phản ứng này CO thể hiện tính chất gì ?
Hướng dẫn trả lời:
(1) \(CO + {O_2}\).jpg) \(2C{O_2}\)
\(2C{O_2}\)
+2 +4
(2) \(CO + C{l_2}\)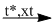 \(COC{l_2}\)
\(COC{l_2}\)
+2 +4
(3) \(CO + CuO\)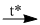 \(Cu + C{O_2}\)
\(Cu + C{O_2}\)
+2 +4
(4) \(CO + F{{\rm{e}}_3}{O_4}\)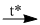 \(3F{\rm{e}} + 4C{O_2}\)
\(3F{\rm{e}} + 4C{O_2}\)
+2 +4
(5) \(CO + {I_2}{O_5}\) \({I_2}\) + \(5C{O_2}\)
\({I_2}\) + \(5C{O_2}\)
+2 +4
Trong các phản ứng này CO thể hiện tính khử.
Bài tập 3.8 trang 22 sách bài tập(SBT) hóa học 11
3.8. Hoàn thành các phương trình hoá học sau :
(1) \(C{O_2} + Mg\)
(2) \(C{O_2} + CaO \to \)
(3) \(C{O_{2(dư)}} + Ba{(OH)_2} \to \)
(4) \(C{O_2} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)
(5) \(C{O_2} + CaC{O_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)
(6) \(C{O_2} + {H_2}O\)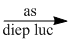 \({C_6}{H_{12}}{O_6}\) + ?
\({C_6}{H_{12}}{O_6}\) + ?
Hướng dẫn trả lời:
(1) \(C{O_2} + Mg\)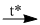 \(2MgO + C\)
\(2MgO + C\)
(2) \(C{O_2} + CaO \to \) \(CaC{O_3}\)
(3) \(C{O_{2(dư)}} + Ba{(OH)_2} \to \) \(Ba{(HC{O_3})_2}\)
(4) \(C{O_2} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) \({H_2}C{O_3}\)
(5) \(C{O_2} + CaC{O_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) \(Ca{(HC{O_3})_2}\)
(6) \(C{O_2} + {H_2}O\)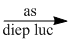 \({C_6}{H_{12}}{O_6}\) + \(6{O_2}\)
\({C_6}{H_{12}}{O_6}\) + \(6{O_2}\)
ưBài tập 3.9 trang 23 sách bài tập(SBT) hóa học 11
3.9. Hãy điền dấu (+) vào trường hợp nào có và dấu (-) vào trường hợp nào không có phản ứng hoá học xảy ra giữa các chất sau đây :
| | \(C{O_{2(k)}}\) | \({(N{H_4})_2}C{O_{3({\rm{dd}})}}\) | \(NaHC{O_{3({\rm{dd}})}}\) | \(Ba{(HC{O_3})_{2({\rm{dd}})}}\) |
\(N{a_2}S{O_{4({\rm{dd}})}}\) | | | | |
\(NaO{H_{({\rm{dd}})}}\) | | | | |
\(BaC{l_2}_{({\rm{dd}})}\) | | | | |
\(Ca{O_{(r)}}\) | | | | |
Hướng dẫn trả lời:
| | \(C{O_{2(k)}}\) | \({(N{H_4})_2}C{O_{3({\rm{dd}})}}\) | \(NaHC{O_{3({\rm{dd}})}}\) | \(Ba{(HC{O_3})_{2({\rm{dd}})}}\) |
\(N{a_2}S{O_{4({\rm{dd}})}}\) | - | - | - | + |
\(NaO{H_{({\rm{dd}})}}\) | + | + | + | + |
\(BaC{l_2}_{({\rm{dd}})}\) | - | + | - | - |
\(Ca{O_{(r)}}\) | + | + | + | + |
Bài tập 3.10 trang 23 sách bài tập(SBT) hóa học 11
Có một hỗn hợp ba muối \(N{H_4}HC{O_3}\), NaHCO3, Ca(HCO3)2. Khi nung 48,8 g hỗn hợp đó đến khối lượng không đổi, thu được 16,2 g bã rắn. Chế hoá bã rắn với dung dịch HCl lấy dư, thu được 2,24 lít khí (đktc).
Xác định thành phần phần trăm của các muối trong hỗn hợp.
Hướng dẫn trả lời:
Các phản ứng phân hủy muối khi nung :
\(N{H_4}HC{O_3}\).jpg) \(N{H_3} + C{O_2} + {H_2}O\) (1)
\(N{H_3} + C{O_2} + {H_2}O\) (1)
\(2NaHC{O_3}\).jpg) \(N{a_2}C{O_3} + C{O_2} + {H_2}O\) (2)
\(N{a_2}C{O_3} + C{O_2} + {H_2}O\) (2)
\(Ca{(HC{O_3})_2}\).jpg) \(CaO + 2C{O_2} + {H_2}O\) (3)
\(CaO + 2C{O_2} + {H_2}O\) (3)
Bã rắn thu được sau khi nung gồm Na2CO3 và CaO, chúng tan trong dung dịch HCl dư theo các phương trình hoá học :
\(N{a_2}C{O_3} + 2HCl \to 2NaCl + C{O_2} + {H_2}O\) (4)
\(CaO + 2HCl \to CaC{l_2} + {H_2}O\) (5)
Theo (4) :
\({n_{N{a_2}C{O_3}}} = {n_{C{O_2}}} = \frac{{2,24}}{{22,4}}\) = 0,1 (mol), hay 106.0,1 = 10,6 (g) \(N{a_2}C{O_3}\)
Theo (2) :
\({n_{NaHC{O_3}}} = 2.{n_{N{a_2}C{O_3}}}\) = 2.0,1 =0,2 (mol), hay 84.0,2 = 16,8 (g) \(NaHC{O_3}\).
Số mol CaO có trong bã rắn : \(\frac{{16,2 - 10,6}}{{56}}\) = 0,1 (mol).
Theo (3):
\({n_{Ca{{(HC{O_3})}_2}}} = {n_{CaO}}\) = 0.1 (mol), hay 162.0,1 = 16,2 (g) Ca(HCO3)2.
Khối lượng \(N{H_4}HC{O_3}\) có trong hỗn hợp : 48,8 - (16,8 + 16,2) = 15,8 (g).
Thành phần phần trăm của hỗn hợp muối :
\(\begin{array}{l}
\% {m_{N{H_4}HC{O_3}}} = \frac{{15,8.100\% }}{{48,8}} = 32,38\% ;\\
\% {m_{NaHC{O_3}}} = \frac{{16,8.100\% }}{{48,8}} = 34,43\% ;\\
\% {m_{Ca(HC{O_{3{)_2}}}}} = \frac{{16,2.100\% }}{{48,8}} = 33,19\% .
\end{array}\)
congdong.edu.vn