Bài tập trắc nghiệm 2.7, 2.8 trang 12 sách bài tập(SBT) hóa học 11
2.7. Trong dung dịch, amoniac là một bazơ yếu là do
A. amoniac tan nhiều trong nước.
B. phân tử amoniac là phân tử có cực.
C. khi tan trong nước, amoniac kết hợp với nước tạo ra các ion \(N{H_4}^ + \) và \(O{H^ - }\).
D. khi tan trong nước, chỉ một phần nhỏ các phân tử amoniac kết hợp với ion H+ của nước, tạo ra các ion \(N{H_4}^ + \) và \(O{H^ - }\).
2.8. Dãy nào dưới đây gồm các chất chứa nguyên tử nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính oxi hoá khi tham gia phản ứng ?
A. NH3, N2O5, N2, NO2
B. NH3, NO, HNO3, N2O5
C. N2, NO, N2O, N2O5
D. NO2, N2, NO, N2O3
Hướng dẫn trả lời:
2.7. D
2.8. D
Bài tập 2.9 trang 12 sách bài tập(SBT) hóa học 11
2.9. Có hiện tượng gì xảy ra khi tiến hành các thí nghiệm sau ?
1. Cho khí amoniac lấy dự tác dụng với đồng(II) oxit khi đun nóng.
2. Cho khí amoniac lấy dư tác dụng với khí clo.
3. Cho khí amoniac tác dụng với oxi không khí khi có platin làm chất xúc tác ở nhiệt độ 850 - 900°C.
Viết các phương trình hoá học minh hoạ.
Hướng dẫn trả lời:
1. Đồng(II) oxit màu đen chuyển thành Cu màu đỏ, có khí không màu thoát ra. Phương trình hoá học :
\(2N{H_3} + 3CuO\)  \({N_2} + 3Cu + 3{H_2}O\)
\({N_2} + 3Cu + 3{H_2}O\)
màu đen màu đỏ
2. Có "khói" trắng bốc lên, đó là những hạt \(N{H_4}Cl\) nhỏ li ti được tạo ra do phản ứng :
\(8N{H_{3(k)}} + 3C{l_{2(k)}} \to {N_{2(k)}} + 6N{H_4}C{l_{(r)}}\)
3. Có khí không màu thoát ra, khí này chuyển sang màu nâu đỏ trong không khí. Các phương trình hoá học :
4NH3 + 5O2 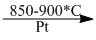 4NO + 6H20
4NO + 6H20
\(2N{O_{(k)}} + {O_{2(k)}} \to 2N{O_{2(k)}}\)
(không màu) (màu nâu đỏ)
Bài tập 2.10 trang 12 sách bài tập(SBT) hóa học 11
2.10. Phản ứng tổng hợp amoniac là phản ứng thuận nghịch :
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) \(\Delta \)\(H\) = -92 kJ
Cân bằng của phản ứng này chuyển dịch như thế nào khi thay đổi một trong các điều kiện sau đây ? Giải thích.
1. Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
2. Giảm nhiệt độ.
3. Thêm khí nitơ.
4. Dùng chất xúc tác thích hợp.
Hướng dẫn trả lời:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) \(\Delta \)\(H\) = -92 kJ
1. Khi tăng áp suất chung, cân bằng chuyển dịch theo chiều từ trái sang phải là chiều tạo ra số mol khí ít hơn.
2. Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiéu từ trái sang phải là chiều của phản ứng toả nhiệt.
3. Khi thêm khí nitơ, khí này sẽ phản ứng với hiđro tạo ra amoniac, do đó cân bằng chuyển dịch từ trái sang phải.
4. Khi có mặt chất xúc tác, tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch tăng lên với mức độ như nhau, nên cân bằng không bị chuyển dịch. Chất xúc tác làm cho cân bằng nhanh chóng được thiết lập.
congdong.edu.vn